Una candela un piatto... - Divulgazione scientifica, ottica, biologia e molto altro ancora.....
Menu principale:
- Home Page
- Divulgazione
-
Esperimenti scientifici
- Indice esperimenti scientifici
- Realizziamo un Erbario
- Giocattoli
- Esperimenti di elettrochimica
- Analisi lessicale dei testi
- Esplorazione dell'ambiente
- La collana di democrito
- La collana di Democrito - Soluzione
- Come trovare idee per esperimenti scientifici
- Esperimenti Scientifici di Educazione Ambientale e Biologia
- Fenomeni di supperficie e colloidi
- Esperimenti con acidi e basi
- Fabbricazione e riciclo della carta
- Un accendino paleolitico
- Tavolette cuneiformi
- Storia della scrittura
- Come estrarre DNA dalla frutta
- Raccolta e analisi delle micrometeoriti
- Una candela un piatto...
- Divertirsi con le cellule fotovoltaiche
- Ottica
-
Microscopia
- Indice microscopia
- Microscopio a sfera di vetro
- Microscopio stereoscopico
- Le cellule del sangue
- Un microscopio da 1000 lire
- Costruiamo un microscopio stereo zoom
- Stereoscopia ad alto ingrandimento
- Protist park
- Riprese al microscopio
- Polvere
- Micromondi
- Un semplice microscopio stereoscopico
- Un semplice microscopio sterescopico riprogettato
- Un oculare a pupilla alta
- Mitosi in apici radicali di aglio
- Microscopio di Robert Hooke
- Microscopio di Antoni van Leeuwenhoek
- Osservazioni con il microscopio
- Articoli accessori
- Sini
- Indice Sini
- Microscopia ottica
- Esperienze di ottica
- Sezione biologia
- Schede tecniche
- Info
- INFO
Una candela un piatto...
Esperimenti con una Candela, un Piatto, etc.
G. Carboni, settembre 2008. Rivisto nel giugno 2009
|
|
|
|
Figura 1 - Esperimento con una candela, un |
Questa volta ripeteremo un esperimento largamente conosciuto, ma cercheremo di interpretarlo meglio. Data la relativa complessità dell'argomento, questo articolo è adatto a persone provviste di una preparazione di base in chimica e in fisica, come per esempio studenti di licei o di istituti tecnici. Questo esperimento sarà particolarmente gradito a chi ama le sfide, a chi ama affrontare i problemi di carattere scientifico e trae soddisfazione nel risolverli. Buon divertimento!
Come mostra il filmato (figura 1), si tratta di prendere un piatto, incollarvi una candela, mettere dell'acqua nel piatto, accendere la candela, coprire la candela accesa con un Becker capovolto ed osservare quello che succede. Come potete vedere, dopo pochi secondi la candela si spegne e parecchia acqua viene risucchiata all'interno del Becker. Fin qui, niente di particolare. I problemi nascono quando si cerca di interpretare quello che è successo. La spiegazione che mi è quasi sempre capitato di leggere è che l'acqua entrerebbe nel Becker per occupare lo spazio lasciato dall'ossigeno consumato dalla fiamma della candela. E' giusta? Vediamo! A tale scopo, ripetiamo l'esperimento.
CANDELA, PIATTO, ACQUA, BECKER
indice
Procuratevi i seguenti materiali:
- una candela
- un piatto fondo
- dell'acqua
- un Becker da 400 cc
- un po' di sugo di rape rosse
- un paio di guanti
Tradizionalmente, al posto del Becker si usa un bicchiere, noi invece useremo un Becker perché la sua forma cilindrica ci permette determinazioni quantitative e le sue pareti sottili si raffreddano prima.
Tagliate la candela alla lunghezza di 4,5 centimetri, lasciando un po' di stoppino. Accendetela ed attaccatela al centro del piatto per mezzo di qualche goccia di cera fusa. Spegnete la candela. Mettete dell'acqua nel piatto fino a raggiungere un livello di 15 mm circa. Mescolate all'acqua un po' di sugo di rape rosse, in modo da migliorare la visibilità del liquido. Accendete nuovamente la candela, aspettate qualche secondo che la fiamma si stabilizzi, poi coprite la candela con il Becker capovolto (figure 2 e 3). Appena la fiamma della candela si spegnerà, vedrete una certa quantità d'acqua risalire tumultuosamente nel Becker (figura 4).
 |
 |
 |
| Figura 2 - Mettete
un Becker capovolto sulla candela. |
Figura 3 - Dopo pochi secondi,
la candela si spegne. |
Figura 4 - Dentro il
Becker, il livello dell'acqua sale. |
Come ho detto, questo fenomeno viene comunemente spiegato con la combustione dell'ossigeno all'interno del Becker ad opera della fiamma della candela. La sottrazione di questo gas creerebbe una depressione che richiamerebbe l'acqua all'interno del Becker. A riprova della bontà di questa spiegazione viene fatto osservare che il livello dell'acqua si è alzato di circa un quinto del volume del gas rimanente, più o meno il volume che l'ossigeno occupa nell'atmosfera.
A me è però venuto il sospetto che questa spiegazione non fosse valida. Infatti, nella fiamma della candela l'ossigeno atmosferico si combina con atomi di carbonio forniti dalla candela formando anidride carbonica. In particolare, per ogni molecola di ossigeno consumato, viene prodotta una molecola di anidride carbonica, quindi dal momento che il numero di molecole non cambia, il volume del gas presente nel Becker non deve cambiare per questo motivo.
La cera, la paraffina e la stearina, materiali di cui sono formate le candele, sono ricche di carbonio. Per ogni molecola di ossigeno che reagisce con un atomo di carbonio viene prodotta una molecola di anidride carbonica (C + O2 = CO2). In base alla legge di Avogadro, a parità di pressione e di temperatura, il volume di un gas è proporzionale al numero di molecole di cui è composto. Poiché il numero di molecole di O2 presenti all'inizio della combustione è pari al numero di molecole di CO2 alla fine della combustione, il volume di gas all'interno del Becker deve rimanere costante.
Allora perché vediamo alzarsi il livello dell'acqua nel Becker? Certamente ciò non avviene a causa della produzione di CO2. L'ipotesi che mi sembra più verosimile è che al momento di coprire la candela con il Becker, si intercetta una colonna ascensionale di aria calda. Dopo che la fiamma si è spenta, questo gas raffreddandosi si contrae e crea una depressione che richiama l'acqua all'interno del Becker.
Facciamo ora una prova per verificare la validità di questa ipotesi.
STESSO ESPERIMENTO, SENZA
LA CANDELA
indice
In questo secondo esperimento, faremo a meno della candela e per avere dell'aria calda dentro al Becker, lo scalderemo con dell'acqua bollente. Riempite quindi il Becker di acqua bollente e aspettante un minuto che il Becker si scaldi (figura 5). Per evitare che il Becker si rompa, prima di versare l'acqua potete mettere al suo interno un cucchiaino. Indossate un guanto e vuotate il Becker versando l'acqua nuovamente nella pentola (non nel piatto!). Tenete il Becker capovolto per una dozzina di secondi (figura 6) per permettere all'aria contenuta di scaldarsi. Lentamente per non scacciare l'aria calda, posate il Becker nel piatto contenente l'acqua colorata (senza la candela). Anche in questo caso vedrete l'acqua venire risucchiata dentro al Becker (figura 7). Questa volta però il processo sarà molto più lento perché è necessario che il Becker e l'aria che contiene si raffreddino. Se avete usato un Becker con pareti abbastanza sottili, ci vorrà circa un quarto d'ora. Con un bicchiere dalle pareti spesse ci vorrebbe molto di più. Per accelerare il raffreddamento, potete anche soffiare sul Becker o mandargli aria con un ventaglio. Non impiegate aria a temperatura più bassa di quella ambiente.
|
|
|
|
|
Figura 5 - Versate acqua
bollente |
Figura 6 - Tenete il
Becker capovolto |
Figura 7 - Lentamente, dopo
avere posato |
Questo secondo esperimento, nel quale abbiamo tolto la candela, dimostra che l'aria calda presente nel Becker raffreddandosi si contrae. Quindi, a produrre una riduzione del volume del gas all'interno del Becker partecipa anche l'aria calda che abbiamo intrappolato nel momento in cui abbiamo messo il Becker sulla candela accesa.
A questo punto, potrebbe venire il sospetto opposto che la riduzione di volume del gas nel Becker sia dovuta solo all'aria calda intercettata dal Becker. Prima di trarre questa conclusione, osservate bene quello che succede durante l'esperimento con la candela. Riavviate il filmato di figura 1. Come potete notare, mentre il Becker viene deposto sulla candela, al suo interno ci sono alcune gocce d'acqua, ma non c'è condensa. Invece quando la candela si spegne, all'interno del Becker resta una condensa di vapor acqueo. Potete vedere la condensa anche nelle figure 3 e 4. Da dove viene?
Cerchiamo ora di esaminare questo fenomeno alla luce della chimica. Le candele sono formate principalmente da cera, paraffina e stearina. Si tratta di sostanze composte da lunghe catene di carbonio e di idrogeno e, per quello che riguarda la cera e la stearina anche da alcuni atomi di ossigeno. A titolo di esempio, la formula di una paraffina è la seguente: C16H34, mentre la formula di una cera è la seguente: C43H86O2. La loro combustione con l'ossigeno atmosferico non produce solo anidride carbonica (CO2), ma anche acqua (H2O). Poiché esistono diversi tipi di cera, di paraffina e di stearina, la definizione quantitativa e precisa dei prodotti della loro combustione non è possibile a meno di non conoscere la composizione della candela.
Per dare un'idea di quello che succede durante la combustione di una candela, immaginiamo che essa sia formata tutta da molecole di un solo tipo di paraffina, quello che risponde alla formula C16H34, già citata. La combustione di questa molecola produce 16 molecole di CO2 e 17 molecole di H2O con un consumo di 32 e di 17 atomi di ossigeno rispettivamente. La combustione di una molecola di questa paraffina richiede 32 + 17 = 49 atomi di ossigeno. La CO2 è gassosa e, come abbiamo visto, resta nell'atmosfera del Becker senza modificare la pressione. L'H2O prodotta è inizialmente in forma di vapor acqueo che poi condensa rapidamente in acqua. Poiché l'acqua prodotta ha un volume trascurabile, l'ossigeno che si combina all'idrogeno per produrre acqua viene sottratto dal volume del gas presente nel Becker.
Di conseguenza in queste condizioni, solo circa un terzo del volume dell'ossigeno (17/49) verrebbe sottratto al gas presente nel Becker, mentre i due terzi (32/49) continuerebbero a far parte di tale gas sotto forma di anidride carbonica. Infine, una buona parte della contrazione del gas interno al Becker è dovuta al suo raffreddamento fino a raggiungere la temperatura ambiente. Allo spegnimento della candela, all'interno del Becker non vi sarà più ossigeno libero.
Tornando all'esperimento con la candela, potete osservare che appena la candela si spegne dallo stoppino esce una colonna di fuliggine. Credo che questa fuliggine non abbia sensibili conseguenze sul fenomeno che stiamo studiando. Se però prevedete di fare diverse prove, per evitare di inalare quella fuliggine indossate una mascherina o lavorate in un locale ventilato. Quando togliete il Becker, con un tovagliolo di carta assorbite l'eventuale acqua caduta nel bacinetto della candela.
Come conclusione di questi esperimenti, mi sembra di poter dire che l'affermazione per cui la risalita dell'acqua nel Becker sarebbe dovuta alla combustione dell'ossigeno sia vera solo in piccola parte (produzione di acqua), mentre la maggior parte di tale risalita sarebbe dovuta alla contrazione termica del gas caldo intrappolato nel Becker. Il consumo di ossigeno nella produzione di anidride carbonica non avrebbe invece alcuna influenza.
Fino a qua abbiamo svolto delle considerazioni semiquantitative che hanno avuto un valore essenzialmente introduttivo. Rimboccatevi le maniche perché ora cercheremo di precisarle.
"CONSUMO" DELL'OSSIGENO E
CONTRAZIONE TERMICA
indice
In questa seconda parte dell'articolo, cercheremo di precisare il contributo della sottrazione di ossigeno per formare acqua e quello della contrazione termica del gas nella risalita del liquido nel Becker. Continueremo poi per una serie di altre determinazioni che ci permetteranno di descrivere più precisamente il fenomeno.
Materiali
- un piatto fondo;
- un Becker della capacità di 400 cc. La forma di questo recipiente deve
essere cilindrica e piuttosto slanciata;
- una candela di paraffina lunga 45 mm;
- attaccate la candela al fondo
del piatto per mezzo di qualche goccia di paraffina fusa, poi spegnete la candela;
- un righello;
- un accendino;
- acqua colorata con sugo di rape rosse. Versatene 15 mm nel piatto;
- tovaglioli di carta;
- una mascherina per non respirare la fuliggine, oppure areate il locale.
Terminologia
Il termine "iniziale" si riferisce al momento in cui il Becker viene posto sulla
candela.
Il termine "finale" si riferisce al momento in cui, dopo che la fiamma si
è spenta, il
sistema assume la temperatura ambiente. Poiché, il sistema ci mette parecchio
tempo a raggiungere questo equilibrio, potete definire un tempo di attesa
convenzionale (per esempio di 5 minuti) dopo lo
spegnimento della candela.
L'aria è composta di azoto (78,09 %), ossigeno (20,95 %), argon (0,92 %),
anidride carbonica (0,03 %) e altri gas per dei tenori che nel nostro caso sono
del tutto trascurabili. L'azoto non reagisce con la fiamma della candela né
reagisce l'argon essendo un gas nobile. Con N2 indico qui i gas inerti dell'aria
(l'azoto, l'argon, etc.), arrotondando il loro tenore complessivo al 79 %. L'ossigeno invece reagisce e arrotondo il
suo tenore al 21 %.
Ipotesi Iniziali
Il volume dei gas inerti è pari al 79 % dell'aria.
Il volume dell'ossigeno è pari al 21 % dell'aria.
Viene usata una candela di paraffina tutta della composizione seguente: C16H34.
Nella combustione di una molecola di questa paraffina, si formano 16 molecole di CO2 e 17 molecole di H2O con un consumo di 32 e 17 atomi di ossigeno rispettivamente (32 + 17 = 49 atomi di ossigeno forniti dall'aria per ogni molecola di paraffina ossidata).
Il bilanciamento della reazione è il seguente: 2 C16H34 + 49 O2 = 32 CO2 + 34 H2O da cui si ricava che 17 / 49 molecole di ossigeno (circa un terzo) vengono impiegate per la produzione di acqua (con variazione di volume del gas). I rimanenti due terzi sono utilizzati nella produzione di anidride carbonica (senza variazione di volume del gas).
Viene usato un Becker cilindrico.
Il volume della candela è trascurato.
Il volume della fuliggine che si forma durante lo spegnimento è trascurato.
Il livello iniziale dell'acqua nel Becker (Li) è trascurato;
Il volume dell'acqua prodotta è trascurato.
La risalita dell'acqua nel Becker è dovuta in parte al consumo di ossigeno
atmosferico per produrre acqua e in parte alla contrazione termica del gas nel
Becker.
Metodo
A partire dal volume dei gas inerti nel Becker dopo lo spegnimento della
candela, è possibile conoscere il
volume di O2 trasformato in acqua. Questo ci permette di conoscere la
parte rimanente della risalita che è quella dovuta alla contrazione termica.
Note
Nel misurare l'altezza dell'acqua risalita nel Becker, fate riferimento al bordo
inferiore del menisco del liquido.
Tenete conto del fatto che la scala del righello comincia qualche mm dopo il
bordo dello stesso.
Nel posarlo nel piatto, tenete il Becker come descritto nel paragrafo: "Livello
iniziale dell'acqua nel Becker". Esercitatevi un po' prima di cominciare gli
esperimenti con la candela accesa.
Fate la misura della risalita dell'acqua dopo un tempo fisso per consentire di
avere condizioni termiche più vicine possibile fra le varie esperienze. Potete
per esempio attendere
5 minuti dallo spegnimento della candela. Se dovete ripetere parecchie volte
questa esperienza, ogni ora lasciate raffreddare il sistema. Con un termometro,
misurate la temperatura dell'acqua nel piatto per essere sicuri che il sistema
sia tornato in equilibrio con l'ambiente.
|
|
Simboli
Premessa: Essendo i volumi all'interno del Becker proporzionali
all'altezza dei corrispondenti spazi occupati nel Becker, sarà molto facile passare dalle
altezze ai volumi e viceversa. Le misure di
altezza verranno fatte con un righello.
Vi = volume dell'aria intrappolata nel Becker all'inizio dell'esperienza;
Vi = VN2 + VO2 il volume iniziale è pari al volume dei gas inerti più il volume di
ossigeno;
VN2 = volume iniziale dei gas inerti;
VN2 = 79 % Vi;
VO2= volume iniziale dell'ossigeno contenuto nel
Becker;
VO2= 21 % Vi;
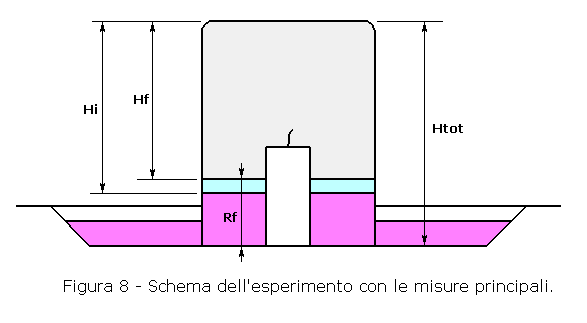
Hi = altezza corrispondente al volume iniziale di aria nel Becker
(Vi). Ignota, da determinare;
Hf = altezza corrispondente al volume finale di gas nel Becker (Vf). Può essere
misurata;
Hf = Htot - Rf
Htot = altezza del Becker misurata al suo interno;
Rf = altezza finale dell'acqua nel Becker (misurata con un righello);
Vf = volume finale del gas nel Becker
Vf = VN2 + VCO2 è pari al volume dei gas
inerti iniziali più il volume di anidride carbonica prodotta;
VCO2 = 32/49 x 0,21 Vi
VO2 = volume di
O2 sottratto per la combustione dell'H2 con formazione di
H2O (in azzurro nella figura 8);
VO2 = Vi - Vf
Vct = volume dovuto alla contrazione termica del gas presente nel Becker (in
rosso nel Becker, figura 8).
Calcoli
Vf = VN2 + VCO2
VN2 = 0,79 Vi
VCO2 = 32/49 x 0,21 Vi
Vf = 0,79 Vi + 32/49 x 0,21 Vi
Vf = (0,79 + 32/49 x 0,21) Vi
Vi = Vf / (0,79 + 0,137)
Vi = Vf /0,927 il volume iniziale di gas può essere determinato a partire
dal volume finale.
|
|
|
|
Figura 9 - Misura del livello dell'acqua (Rf). |
Figura 10 - Nel rilevare il livello
dell'acqua, fate riferimento al |
Determinazione pratica
Ho eseguito 6 prove di cui ne ho scartata una perché in fase di risalita
dell'acqua, è passata aria sotto il beccuccio del Becker.
Per evitare il passaggio di aria in corrispondenza del beccuccio del Becker,
applicate in quella posizione un pezzo di nastro adesivo.
Per semplicità, in questi calcoli ho utilizzato le altezze raggiunte dall'acqua
nel Becker perché sono proporzionali ai volumi. Quando necessario,
queste misure potranno essere convertite nei rispettivi volumi.
Htot = 91 mm, altezza interna del Becker;
Rf = altezza della risalita dell'acqua nel Becker;
Rf = 27 mm, media di 5 valori.
Hf = Htot - Rf
Hf = 91 - 27
Hf = 64 mm. Altezza corrispondente al volume finale (Vf);
Hi = Hf / (0,79 + 32/49 x 0,21) vedi:
"Calcoli";
Hi = 64 / (0,79 + 0,137)
Hi = 64 / 0,927
Hi = 69,04 mm. Altezza dell'aria nel Becker all'inizio dell'esperienza (Vi);
Hox = Altezza corrispondente al volume di
O2
sottratto per ossidare l'H della paraffina (in azzurro nella figura 8);
Hox = Hi - Hf
Hox = 69,04 - 64
Hox = 5,04 mm
Hct = Htot - Hi. Altezza corrispondente alla
contrazione termica del volume di gas nel Becker;
Hct = 91 - 69,04
Hct = 21,96 mm
Rapporto Hct / Hox = 4,36. La contrazione
termica del gas intrappolato corrisponde a 4,36 volte quella dovuta alla
sottrazione di ossigeno per formare acqua.
Detto in altri termini, la contrazione termica del gas intrappolato nel
Becker contribuisce alla risalita dell'acqua per oltre 4 quinti del totale,
mentre la sottrazione di ossigeno per formare acqua contribuisce per meno di un
quinto.
Se volete trasformare queste altezze in volume, è sufficiente moltiplicarle per l'area interna del Becker (valori espressi in centimetri). Nel mio caso, il diametro interno del Becker è pari a 6,7 cm, da cui ottengo una superficie di 35,26 cm2. Comunque, al fine di conoscere il contributo dei fattori che producono la risalita dell'acqua, il passaggio ai volumi non è necessario.
Con questi risultati, abbiamo risposto al quesito iniziale su quanto contribuisse la contrazione termica del gas intrappolato nel Becker e la sottrazione di ossigeno per formare acqua durante la combustione della candela. Ora, continuiamo a compiere altre determinazioni nel tentativo di descrivere più esaurientemente quello che succede durante questo fenomeno.
TEMPERATURA DEL GAS INTRAPPOLATO NEL BECKER
indice
In base all'entità della contrazione del gas,
è possibile determinare la sua temperatura media iniziale.
91 mm altezza totale del Becker
5 mm altezza relativa alla condensazione del vapor acqueo
91 - 5 = 86 mm altezza iniziale efficace per questo calcolo
69 - 5 = 64 mm altezza finale efficace
295,15 = temperatura ambiente in °K, corrispondente a 22 °C
64 : 295,15 = 86 : X
X = 396,6 °K
X = 123,5 °C
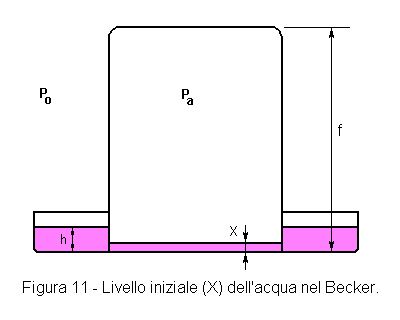
LIVELLO INIZIALE DELL'ACQUA NEL BECKER
indice
|
1 - DETERMINAZIONE SPERIMENTALE 2 - DETERMINAZIONE ANALITICA Pa = P0 + h - X Dal sistema di queste due relazioni, è
possibile ottenere un'equazione di secondo grado che ammette una soluzione.
|
|
VOLUME DELL'ACQUA PRODOTTA
indice
5 mm = risalita dovuta alla combustione di
idrogeno per produrre acqua;
35,26 cm2 = area interna del Becker;
0,5 x 35,26 cm2 = 17,63 cm3 volume di O2 consumato e di
vapor acqueo prodotto;
22,4 = volume (litri) di una mole di gas a 0°C;
24,2 = volume di una mole di gas a 22°C (temperatura ambiente nel corso degli esperimenti);
0,000728 moli di H2O rapportate alla quantità di vapor acqueo prodotto;
18 = peso molecolare dell'H2O;
0,000728 x 18 = 0,0131 g di acqua;
ovvero 13 mm3 d'acqua;
corrispondono a 0,3 gocce (circa un terzo di goccia caduta da una pipetta Pasteur).
ESPERIENZE SULLA CONTRAZIONE TERMICA
indice
1 - SENZA LA CANDELA
Se volete approfondire
l'analisi del fenomeno della risalita dell'acqua in assenza della candela,
scaldate il Becker con acqua a diverse temperature, per esempio: 40, 50, 60, 70,
80, 90°C. In questo caso vi servirà un termometro adatto (NON usate quello per
misurare la febbre, ma un termometro per temperature superiori ai 100°C).
Cercate di standardizzare i tempi delle diverse operazioni, come il tempo di
riscaldamento del Becker, il tempo di riscaldamento dell'aria con il Becker
capovolto, il tempo di raffreddamento dell'aria nel Becker. Per ogni prova,
misurate il livello dell'acqua nel Becker con un righello. Alla fine tracciate
un diagramma del livello dell'acqua richiamata nel Becker in funzione della
temperatura dell'acqua che avete usato per scaldarlo. L'andamento di questa
curva è utile per valutare l'affidabilità della teoria formulata.
2 - CON LA CANDELA FUORI DAL PIATTO
Questo esperimento consiste
nell'intercettare la colonna d'aria calda prodotta da una candela tenuta fuori
dal piatto. Accendete dunque la candela e tenetevi sopra un Becker rovesciato
per qualche secondo, poi mettetelo nel piatto fondo con l'acqua come al solito,
però questa volta la candela resterà fuori dal piatto e dal Becker.
Controllate le differenze nella velocità della risalita dell'acqua e nel livello raggiunto. Spiegate queste differenze.
INFLUENZA DEL VOLUME DELLA CANDELA
indice
La presenza della candela all'interno del Becker durante l'esperienza riduce il volume e provoca un aumento apparente della risalita dell'acqua. Tenendo conto di questo fatto, è possibile migliorare la precisione delle determinazioni.
In mezzo a tutti questi calcoli, gli errori si annidano tanto numerosi quanto maliziosi. Scoprirli e neutralizzarli è un vero piacere. Per questo, invito tutti i lettori a segnalare non solo gli errori, ma anche le inutili complicazioni, i passaggi da chiarire ed eventuali altri procedimenti per risolvere gli stessi problemi. Anche segnalare nuovi problemi che non ho considerato è un modo per migliorare questo articolo.
Da queste analisi risulta che la risalita dell'acqua nel Becker sarebbe dovuta per oltre quattro quinti alla contrazione termica del gas intrappolato nel Becker e per circa un quinto alla sottrazione di ossigeno (gassoso) per formare acqua (liquida). Quello che molti non si aspettano è che il consumo dell'ossigeno per produrre anidride carbonica sia invece ininfluente sulla variazione del volume del gas nel Becker.
Riassumo i fattori principali della risalita
dell'acqua nel Becker:
- contrazione termica dei gas intrappolati nel Becker;
- consumo di ossigeno per formare acqua. Questa "sottrazione" di ossigeno è
oltre 4 volte meno importante della contrazione termica dei gas nel Becker;
- consumo di ossigeno per formare anidride carbonica. Questa reazione è
ininfluente;
Se volete condurre altre prove su questo fenomeno, potete cercare di valutare quanto conti coprire lentamente la candela oppure farlo velocemente e quanto influisca il volume del recipiente. Se volete migliorare la precisione dei calcoli, prendete in conto la presenza della candela. Fate prove anche con una candela montata su di un coperchio galleggiante. A tale scopo va bene un piccolo coperchio di un vasetto di marmellata. In questo caso, usate candele tagliate a circa 20 mm di lunghezza.
Con questi approfondimenti, si è trasformata quella che era una semplice curiosità in un esperimento che offre numerosi ed interessanti problemi di fisica e di chimica da affrontare. Un insegnante di liceo o di istituto può proporre ai propri allievi come esercitazione di fisica e di chimica la soluzione dei diversi problemi che si incontrano nel tentativo di precisare le cause della risalita dell'acqua nel Becker.
Alla fine di queste determinazioni ed analisi, possiamo anche concludere che spesso le cose non sono come la gran parte della gente crede che siano. Un piccolo dubbio può aprire la strada per una verifica più approfondita ed a conclusioni abbastanza sorprendenti. Questo dubbio iniziale ci ha dato un piccolo insegnamento, quello di riflettere anche su ciò che viene dato per scontato.
Parole chiave per ricerche in Internet: candela, piatto, Becker, acqua.