Esperimenti di elettrochimica - Divulgazione scientifica, ottica, biologia e molto altro ancora.....
Menu principale:
- Home Page
- Divulgazione
-
Esperimenti scientifici
- Indice esperimenti scientifici
- Realizziamo un Erbario
- Giocattoli
- Esperimenti di elettrochimica
- Analisi lessicale dei testi
- Esplorazione dell'ambiente
- La collana di democrito
- La collana di Democrito - Soluzione
- Come trovare idee per esperimenti scientifici
- Esperimenti Scientifici di Educazione Ambientale e Biologia
- Fenomeni di supperficie e colloidi
- Esperimenti con acidi e basi
- Fabbricazione e riciclo della carta
- Un accendino paleolitico
- Tavolette cuneiformi
- Storia della scrittura
- Come estrarre DNA dalla frutta
- Raccolta e analisi delle micrometeoriti
- Una candela un piatto...
- Divertirsi con le cellule fotovoltaiche
- Ottica
-
Microscopia
- Indice microscopia
- Microscopio a sfera di vetro
- Microscopio stereoscopico
- Le cellule del sangue
- Un microscopio da 1000 lire
- Costruiamo un microscopio stereo zoom
- Stereoscopia ad alto ingrandimento
- Protist park
- Riprese al microscopio
- Polvere
- Micromondi
- Un semplice microscopio stereoscopico
- Un semplice microscopio sterescopico riprogettato
- Un oculare a pupilla alta
- Mitosi in apici radicali di aglio
- Microscopio di Robert Hooke
- Microscopio di Antoni van Leeuwenhoek
- Osservazioni con il microscopio
- Articoli accessori
- Sini
- Indice Sini
- Microscopia ottica
- Esperienze di ottica
- Sezione biologia
- Schede tecniche
- Info
- INFO
Esperimenti di elettrochimica
ESPERIMENTI DI
ELETTROCHIMICA
Giorgio Carboni, Gennaio 1998
| I N D I C E |
Nel 1791 Luigi Galvani scoprì l'elettricità nei nervi di rane che dissezionava. Pensava che l'elettricità fosse di origine animale e che si potesse trovare solo nei tessuti viventi. Pochi anni dopo, nel 1800, Alessandro Volta scoprì che l'elettricità poteva essere prodotta anche con mezzi inorganici. Infatti, utilizzando piastrine di rame e di zinco e tessuto imbevuto di soluzione acida, egli costruì una pila, il primo apparecchio in grado di produrre elettricità. Ci fu subito chi profetizzò che tanto l'elettricità non sarebbe mai servita a niente. Invece, l'elettricità ha avuto un grande successo e l'elettrochimica viene ora insegnata anche nelle scuole.
Ascoltando le lezioni di elettrochimica, molti ragazzi si saranno chiesti perchè mai sia stata inventata questa materia, se proprio fosse necessario inventarla, se il mondo non avrebbe potuto funzionare altrettanto bene senza. Con i piccoli esperimenti che presentiamo, intendiamo far fare la pace tra questi studenti e l'elettrochimica. Infatti, per mezzo di qualche semplice e divertente esperimento è possibile capire alcuni fondamentali concetti di elettrochimica senza doversi concentrare più di tanto. Come potrete vedere, molti di questi esperimenti si prestano ad essere eseguiti in forme diverse. Non è necessario farli tutti, ma potete anche realizzarne uno solo.
VASO POROSO - Per alcuni di questi esperimenti è necessario un vaso poroso. Purtroppo non è facile procurarsi questo componente. Il vaso poroso serve ad ostacolare il mescolamento delle soluzioni, pur permettendone il contatto elettrico e quindi lo scambio di ioni. Per realizzare vasi porosi, potete impiegare del cellophane che potrete comperare presso una cartoleria. Il cellophane è una membrana semipermeabile molto adatta per questo scopo. Fate attenzione perchè non tutte le pellicole trasparenti sono di questo materiale, ma molto spesso sono prodotte con plastica. Questi due materiali si distinguono facilmente facendovi cadere sopra qualche goccia d'acqua, il cellophane si deforma leggermente e passando una mano dall'altra parte potete avvertire l'umidità, mentre la pellicola di plastica non si deforma e non lascia passare umidità. Con un foglio di cellophane, realizzate un cilindro e incollatelo con silicone al fondo del vaso principale, in modo che non lasci passare liquido da fessure. Anche un semplice foglio di carta può essere utilizzato per realizzare vasi porosi, come indicato dalla figura 5. Una parete costituita da un solo strato di carta è troppo permeabile, realizzate quindi il cilindro con tre strati di carta.
ACQUA DISTILLATA - Non utilizzate acqua deionizzata, come quella per il ferro da stiro, che spesso viene venduta come acqua distillata. Comperatela invece in farmacia. Che differenza c'è fra l'acqua deionizzata e quella distillata? Numerose sostanze sono solubili in acqua. Solo alcune di queste sostanze si dividono in ioni positivi e negativi quando vengono poste in acqua. In genere si tratta di quelle le cui molecole hanno un legame prevalentemente ionico, le altre molecole restano intere. Per esempio, lo zucchero si scioglie nell'acqua, ma le sue molecole non vengono scisse in ioni. Nell'acqua deionizzata, possono quindi essere presenti molecole di composti non ionici, ma ugualmente solubili in acqua. Inoltre, se questo tipo di acqua non è stato preparato bene, può contenere quantità significative di ioni. Nell'acqua distillata, sono presenti praticamente soltanto molecole d'acqua.
DOVE PROCURARE I MATERIALI - Potete acquistare i prodotti chimici presso un negozio di forniture per laboratori. Potete trovare questo tipo di negozi nelle vicinanze delle università. Alcune drogherie e alcune ferramenta sono disponibili a procurare alcuni prodotti chimici. Potete acquistare lamine di rame e di zinco presso un rivenditore di metalli. Potete anche rivolgervi presso un artigiano che lavora lamiere di questi metalli per ottenere qualche ritaglio. Per esempio, potete rivolgervi ad un installatore di grondaie e a una ditta che effettua zincature. Per alcune prime prove potete provare ad usare un chiodo o una vite zincata, inoltre non dovrebbe essere difficile trovare un pezzetto di rame o di ottone.
CATODO ED ANODO - Nel corso di questi esperimenti, si parlerà spesso di catodo ed anodo. Come potrete notare, in alcuni casi al catodo è stata assegnata la polarità positiva, in altri quella negativa. Questo si spiega tenendo presente che il catodo è l'elettrodo sul quale avviene una reazione di riduzione. Nel caso di una pila, la riduzione si produce spontaneamente e consuma elettroni, quindi il catodo è il polo positivo. Nel caso di una cella elettrolitica, la riduzione viene forzata fornendo elettroni, quindi il catodo è il polo negativo. Da parte sua, l'anodo avrà in ciascun caso polarità opposta rispetto al catodo.
SOLUZIONI (IMPORTANTE!) - La diluizione di acidi è un'operazione pericolosa. Inserendo acqua in un acido concentrato, avvengono esplosioni che vi provocheranno gravi ustioni. E' necessario invece versare l'acido nell'acqua. Se avete bisogno di diluire un acido, chiedete l'aiuto di un chimico. Anche durante la realizzazione delle soluzioni di solfato di rame e di zinco, inserite il sale nell'acqua e non l'acqua nel sale.
ALTRE PRECAUZIONI - Non toccate direttamente i prodotti chimici con le mani. Non metteteli in bocca e non ingeriteli. Non respirate eventuali vapori. Non conservate le soluzioni in bottiglie per acqua potabile e non lasciatele sui tavoli di casa perchè potrebbero essere scambiate per bevande. Conservate questi composti e le loro soluzioni in luoghi diversi da quelli dove si conservano gli alimenti, fuori dalla portata dei bambini, e mettete delle etichette sui contenitori che indichino chiaramente il contenuto e la pericolosità delle sostanze.
|
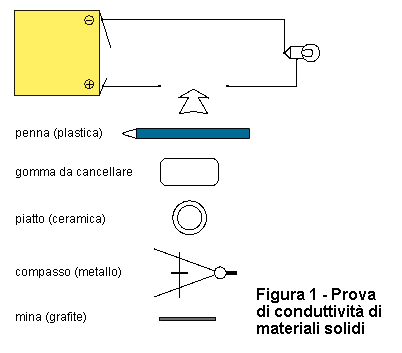
Materiali: - una pila Per mezzo dei materiali indicati, realizzate il montaggio di figura 1. Come vedete, in questo schema abbiamo lasciato una interruzione, la corrente elettrica non passa e la lampadina è spenta. Ora, provate a chiudere questa interruzione utilizzando una penna di plastica, oppure una gomma per cancellare, un pezzo di ceramica, etc. |
Vedrete che quando utilizzerete un metallo, la lampadina si accenderà. Questo avviene perchè i metalli sono ottimi conduttori di elettricità, mentre la plastica, la gomma e la ceramica non conducono. Potete anche provare la mina di una matita. Vedrete che la lampadina farà più o meno luce, a seconda che utilizzerete un pezzo di mina corto o lungo. Questo avviene perchè la grafite, pur essendo un conduttore, oppone una certa resistenza al passaggio delle cariche. In base a questo esperimento, possiamo distinguere i materiali solidi in conduttori e non conduttori, o isolanti. Esistono inoltre molti materiali che possiedono proprietà intermedie, come la grafite.
|
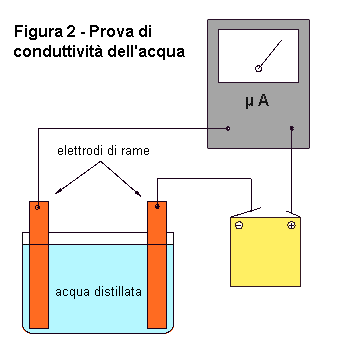
Che cosa dire dell'acqua? Modificate il circuito precedente in modo da poter saggiare la conduttività dell'acqua (fig. 2). Come rivelatore di corrente elettrica, al posto della lampadina, questa volta utilizzate un tester. Questo strumento è più sensibile e vi permette di fare delle misure. Regolate il tester sui µA. Provate ora a chiudere il circuito con l'acqua distillata. A tale scopo, immergete gli elettrodi nell'acqua distillata. Evitate che le lamine si tocchino e fissatele ai bordi del recipiente. Il tester dovrebbe indicare il passaggio di una corrente debolissima. Questa corrente è dovuta alla presenza di ioni H + e OH- prodotti dalla dissociazione/ricomposizione spontanea di molecole d'acqua. La quantità di molecole dissociate in un dato momento è comunque molto piccola. Per questo motivo, la conduttività dell'acqua distillata è molto bassa. Ora, prendete un granello di sale da cucina e gettatelo nell'acqua. Con una bacchetta di vetro o di plastica, mescolate la soluzione. Mano a mano che il cristallo si scioglierà, vedrete l'indicatore del tester spostarsi notevolmente, segnalando un aumento della conduttività della soluzione. Per fare questo esperimento, potete anche fare a meno della pila e regolare il tester sulla scala degli Ohm (in questo caso, utilizzerete la pila interna dello strumento). |
Che cosa è successo? Perchè il sale ha aumentato la conduttività dell'acqua? Il sale da cucina è formato da molecole di cloruro di sodio (NaCl). L'acqua non si limita a sciogliere le molecole del sale, separandole l'una dall'altra, ma divide anche ogni molecola nei due atomi che le costituiscono. Però, dal momento che il sodio possiede un elettrone debolmente legato, mentre il cloro lo attira fortemente per completare la corteccia elettronica esterna, il sodio cede stabilmente l'elettrone al cloro. In questo modo, il sodio diventa elettricamente positivo e il cloro negativo. Essi sono diventati degli ioni. Le molecole di sali, acidi e basi sciolti in acqua, ionizzano, si dissociano cioè in particelle di carica opposta. Sono proprio gli ioni che rendono l'acqua conduttrice. Infatti, gli ioni positivi vengono richiamati dall'elettrodo negativo e viceversa. Nel nostro esperimento, gli ioni Na+ e Cl- hanno reso conduttrice l'acqua distillata. Una soluzione conduttrice si definisce anche elettrolita. Non solo l'acqua, ma anche altri liquidi sono capaci di ionizzare sostanze che vengono poste in soluzione.
Se mettete altri granelli di sale in acqua, vedrete l'ago indicare un passaggio di corrente superiore. Infatti, la conduttività di una soluzione è proporzionale alla sua densità di ioni.
Fate la stessa prova, utilizzando un acido, per esempio aceto. Fate cadere alcune gocce di aceto in acqua distillata, mescolate e osservate l'ago del tester. Fate la stessa cosa impiegando una base, per esempio una soluzione di ammoniaca. Confrontate anche la conduttività dell'acqua di rubinetto rispetto a quella dell'acqua distillata. Come potete osservare, l'acqua di rubinetto è un buon conduttore di elettricità. Per questo motivo, dovete stare molto attenti a non utilizzare apparecchi elettrici quando avete le mani bagnate. Molti incidenti mortali avvengono utilizzando asciugacapelli in questo modo.
Confrontando i conduttori solidi con quelli liquidi, potete notare che, mentre in un filo metallico la corrente passa senza trasportare atomi nè causare reazioni chimiche, il passaggio di corrente in un elettrolita consiste nel movimento di ioni e agli elettrodi si hanno reazioni chimiche. Tra l'altro, queste reazioni tendono a polarizzare gli elettrodi. A causa di questo fenomeno, le pile tendono ad esaurirsi e le misure di conduttività dell'acqua, realizzate con il nostro dispositivo, subiscono una deriva. Nei misuratori di conduttività dell'acqua, gli elettrodi sono realizzati con metalli non ossidabili e vengono alimentati con corrente alternata a bassa tensione.
Come fanno i metalli a condurre l'elettricità se non possiedono ioni che si spostano? Nei metalli, si spostano gli elettroni. Infatti nei metalli, tutti gli atomi condividono gli elettroni più esterni delle loro cortecce elettroniche. Tali elettroni sono liberi di muoversi lungo tutto il pezzo metallico. Se, per mezzo di una differenza di potenziale, vengono forniti degli elettroni da una parte, possono essere raccolti dall'altra e all'interno del metallo ci sarà una corrente elettrica.
I l passaggio di elettroni in un conduttore produce un aumento delle oscillazioni degli atomi del reticolo cristallino. Questo corrisponde ad un aumento della temperatura del materiale (effetto joule). Questo fenomeno viene sfruttato per produrre luce nelle lampadine. Infatti, la corrente di elettroni che attraversa il filamento delle lampadine è abbastanza intensa da produrre l'innalzamento della temperatura di alcune migliaia di gradi. A quella temperatura, il filamento emette una luce intensa.
Perchè i materiali plastici, le gomme e le ceramiche non conducono elettricità? Questo dipende dal tipo di legame chimico, chiamato covalente, che tiene insieme gli atomi di questi materiali. A differenza dal legame metallico, il legame covalente non consente il movimento degli elettroni lungo tutto il pezzo. Gli elettroni vengono scambiati solo fra gli atomi della singola molecola e non sono liberi di muoversi fra le molecole. Non potendoci essere spostamento di elettroni, nè tantomeno movimento di ioni perchè il materiale è solido, non può neppure esserci un trasporto di cariche elettriche.
Prima abbiamo parlato di isolanti e di conduttori. In realtà anche gli isolanti, per quanto poco, qualcosa possono condurre specialmente se hanno uno spessore sufficientemente piccolo e se sono sottoposti ad alte tensioni. Quindi, tutti i materiali vengono considerati conduttori, ma è necessario conoscere la conduttività elettrica di ognuno di essi.
Al termine di questo esperimento, avete visto che alcuni materiali solidi (es: metalli) possiedono una conduttività elettrica maggiore di altri (es: gomme, plastiche, ceramiche). Anche i liquidi possono essere più o meno conduttori di elettricità. Mentre la conduttività di un solido è dovuta al movimento di elettroni nel reticolo cristallino, quella di un liquido è dovuta al movimento di ioni.
LE PILE Materiali: - un limone Rotolate il limone schiacciandolo un po', in modo da rompere una parte dei sacchetti di acido. Piantate le due lamine metalliche dentro al limone, evitando che si tocchino fra loro. Con il tester, misurate la tensione che si produce fra le lamine (figura 3). Il valore di questa tensione sarà di circa 1 volt. |
|
A questo punto, sarebbe bello accendere una lampadina per mezzo della pila che avete appena costruito. Purtroppo, la potenza prodotta è troppo bassa. Se provaste a collegare una lampadina, la tensione della pila al limone cadrebbe immediatamente a zero. Tuttavia, se volete dimostrare che la corrente elettrica prodotta dalle pile può effettivamente far funzionare qualcosa, prendete un piccolo strumento che abbia un display a cristalli liquidi. Un orologio o un termometro vanno bene. Infatti, un display a cristalli liquidi ha un assorbimento di corrente estremamente ridotto e la vostra pila sarà in grado di farlo funzionare. Togliete dunque la pila dell'orologio o del termometro e alimentateli con la pila al limone. Vedrete tornare le cifre sul il display. Questo sistema vi permette di dimostrare la produzione di energia elettrica da parte della pila, anche se non possedete un tester.
Come funziona questa pila? Gli atomi di rame (Cu) attirano gli elettroni verso di sè con una forza maggiore di quanto non facciano gli atomi di zinco (Zn). Se mettete a contatto un pezzo di rame con un pezzo di zinco, molti elettroni passeranno dallo zinco al rame. Concentrandosi sul rame, questi elettroni tendono però a respingersi. Quando il potenziale di repulsione diventa pari a quello con il quale il rame richiama gli elettroni dallo zinco, questo trasferimento si arresta. Purtroppo non è possibile sfruttare il contatto di queste due lamine per produrre energia elettrica perchè il trasferimento di cariche si arresta immediatamente. Invece, se inserite queste due lamine in una soluzione conduttrice e le collegate esternamente con un filo metallico, le reazioni che avvengono agli elettrodi riforniscono il circuito di cariche. In questo modo, il processo di produzione di energia elettrica continua e diventa utilizzabile.
Come soluzione conduttrice, potete prendere qualsiasi elettrolita, quindi una soluzione
acquosa di un acido o di una base o di un sale. La pila al limone funziona proprio perchè
il succo di limone è acido. Fate prove anche con altre soluzioni conduttrici. Come
sapete, anche altri frutti e ortaggi possiedono al proprio interno succhi ricchi di ioni e
che sono quindi dei conduttori elettrici. Non siete quindi obbligati a utilizzare limoni
per fare questo tipo di pila, ma potete fare pile con ogni frutto od ortaggio che volete.
Come ogni batteria, anche questa ha una durata limitata. Infatti, dopo poco tempo, sugli
elettrodi di questa pila avvengono delle reazioni chimiche di un altro tipo che li
polarizzano ed impediscono alla reazione di proseguire. La forza elettro-motrice (fem)
cala e la pila non funziona più. Normalmente, quello che avviene è una produzione di
idrogeno sull'elettrodo di rame e sull'elettrodo di zinco si formano dei composti di
ossidazione che ostacolano il contatto tra il metallo e l'elettrolita. A questo punto, si
dice che gli elettrodi sono polarizzati. Per ottenere una maggiore durata della pila e una
maggiore erogazione di energia elettrica, occorre utilizzare un elettrolita più adatto.
Nelle pile che si trovano in commercio, oltre agli elettroliti, vengono usate delle
sostanze chimicamente affini all'idrogeno le quali, combinandosi con questo elemento,
agiscono da depolarizzanti.
|
Materiali: - una lamina di rame |
|
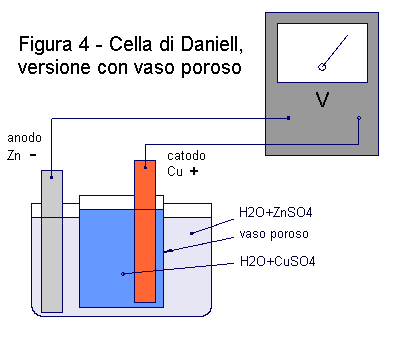
Preparate una soluzione abbastanza concentrata di solfato di rame in acqua distillata e un'altra soluzione, più o meno della stessa concentrazione, di solfato di zinco in acqua distillata. Per entrambe queste soluzioni, potete sciogliere dai 10 ai 30 grammi di sale ogni 100 cc di acqua distillata. Realizzate il montaggio mostrato dalle figure 4 e 5. Versate la soluzione di CuSO4 dove avete messo l'elettrodo di rame e la soluzione di ZnSO4 dove si trova l'elettrodo di zinco. Collegando il tester, misurerete una tensione di 1,1 volt. Rispetto alla pila al limone, la cella di Daniell ha una potenza superiore e un funzionamento molto più prolungato. Tuttavia, per riuscire ad accendere una lampadina, occorre avere elettrodi di superficie ampia, elettroliti concentrati. Provate con un LED.
|
Come funziona la pila di Daniell? Come abbiamo detto, le reazioni che avvengono agli elettrodi forniscono cariche e permettono alla pila di produrre energia per lungo tempo. Nella pila di Daniell, la lamina di rame richiama elettroni da quella di zinco. Essi passano attraverso i cavi del circuito esterno. Ricevendo questi elettroni, l'elettrodo di rame richiama gli ioni positivi dell'elettrolita. Quindi, gli ioni Cu++ si dirigono verso l'elettrodo di rame, dove prelevano due elettroni, si neutralizzano e si depositano in forma metallica, quelli Zn++ si muovono verso il vaso poroso. Per ogni atomo di rame che si deposita, un atomo di zinco va in soluzione cedendo due cariche al proprio elettrodo. |
Le reazioni agli elettrodi sono le seguenti:
Zn --> Zn++ + 2e-
Cu++ + 2e- --> Cu
Queste reazioni si risolvono in una solubilizzazione di atomi di zinco in forma ionica, cui corrisponde una deposizione di ioni di rame in forma metallica:
Zn + Cu++ --> Zn++ + Cu
Gli elettroni ceduti dagli atomi di zinco, passano attraverso il filamento della lampadina, producono luce per effetto joule e raggiungono l'elettrodo di rame che li richiama. Sono questi elettroni che costituiscono la corrente erogata dalla pila. Se non ci fosse il vaso poroso, gli ioni Cu++ andrebbero a prelevare gli elettroni direttamente sull'elettrodo di zinco e non ci sarebbe più passaggio di corrente attraverso il circuito esterno. Di conseguenza, la pila non funzionerebbe più. Poichè l'elettrodo di rame richiama elettroni dal circuito esterno, è considerato il polo positivo della pila.
|
Nelle pile, abbiamo dunque un passaggio di elettroni nel circuito esterno (circuito elettrico) e un movimento di ioni nel circuito interno (circuito elettrolitico). Anche la pila di Daniell non funziona indefinitamente, ma soltanto finchè ci sono ioni Cu++ disponibili oppure finchè non si è consumato l'elettrodo di zinco. In realtà, la produzione di corrente si ferma prima, a causa dell'aumento della concentrazione dell'elettrolita dalla parte dell'elettrodo di zinco e della sua diminuzione di concentrazione dalla parte dell'elettrodo di rame. Infatti, la quantità di ioni positivi prodotti dall'elettrodo di zinco richiama ioni SO4 per bilanciare le cariche dell'elettrolita. L'inverso avviene all'elettrodo di rame che viene impoverito di ioni positivi. |
Poichè la forza elettromotrice di una pila non dipende solo dalla natura dei suoi componenti, ma anche dalla concentrazione degli elettroliti, il gradiente di concentrazione che si ha in seguito all'erogazione di corrente, fa scendere sempre più la tensione della pila, finchè essa non riesce più a produrre una sufficiente quantità di corrente e viene considerata esaurita. Alla fine, anche gli ioni Zn++ raggiungono l'elettrodo di rame, lo circondano creando una polarizzazione che ostacola il movimento degli ioni Cu++.
|
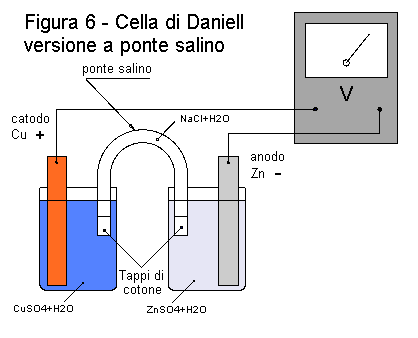
Potete costruire la cella di Daniell anche senza utilizzare il vaso poroso, ma usando un ponte salino (fig. 6 e 7). Questo dispositivo è formato da un tubo piegato ad "U", contenente una soluzione salina. Potete realizzare il ponte con un pezzo di tubo di plastica per giardinaggio, riempito con una soluzione di nitrato di potassio (KNO3) o di sale da cucina (NaCl) in acqua distillata (circa 10 g di sale ogni 100 cc di acqua). Per evitare il rapido mescolamento di questa soluzione negli elettroliti della pila, dovete chiudere le estremità del tubo con tappi di cotone idrofilo pressato. Il ponte salino esercita le stesse funzioni del vaso poroso, di impedire il mescolamento degli elettroliti e di permetterne il contatto elettrico. |
|
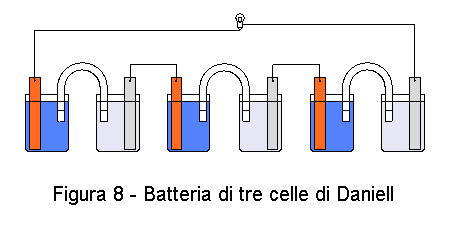
Se volete ottenere una tensione superiore, collegate più celle di Daniell in serie come mostrato dalla figura 8. Notate che, tra una coppia e l'altra, il collegamento è metallico e non con ponte salino.
|
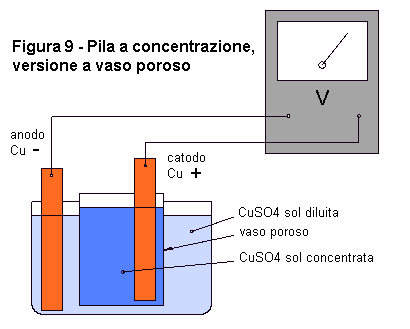
Materiali: - due lamine di rame |
Il dispositivo sperimentale che utilizzerete questa volta (fig. 9) è molto simile a quello della cella di Daniell (fig. 4 e 5). Questa pila sfrutta la tendenza di due soluzioni aventi concentrazione diversa a raggiungere la stessa concentrazione. Quindi, come elettrodi prendete due lamine dello stesso materiale, nel caso particolare, di rame. Come elettroliti usate due soluzioni di solfato di rame, una concentrata (30 g di sale ogni 100 cc di acqua) e l'altra diluita (2 g di sale ogni 100 cc di acqua). Chiudendo il circuito esterno, vedrete il tester indicare il passaggio di una corrente.
|
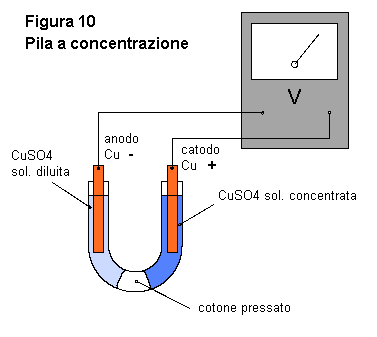
Che cosa succede in questa pila? Agli elettrodi si hanno due reazioni di ossidoriduzione dello stesso tipo, ma che avvengono in soluzioni con concentrazioni differenti. Per questo motivo, si avrà una differenza di potenziale fra i due elettrodi. All'anodo, atomi di rame passano in soluzione cedendo elettroni, mentre al catodo, ioni di rame si depositano sull'elettrodo acquistando elettroni. Cu --> Cu++
+ 2e- Lo stesso tipo di pila, si può realizzare in modo più semplice, senza dover procurare il vaso poroso, con un tubo di vetro, o più praticamente, con un tubo di plastica per giardinaggio piegato ad "U" (fig. 10). Sul fondo di questo deve esserci del cotone idrofilo pressato, la cui funzione è quella di evitare il rapido mescolamento delle soluzioni. Inserite le soluzioni e gli elettrodi. In questo modello, la pila dura poco tempo, fino a quando le soluzioni avranno equilibrato la concentrazione attraverso la "barriera" di cotone. |
|
|
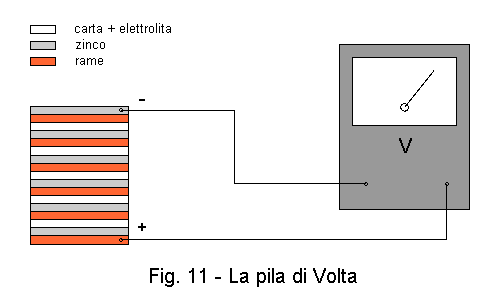
Materiali: - 6 lamine o dischi di rame |
|
Nel suo famoso esperimento del 1800, Alessandro Volta utilizzò una soluzione di acido solforico come elettrolita. Quando è concentrato, questo acido è pericoloso. Se arriva sulla pelle o sugli occhi, provoca gravi ustioni e può accecare. Dal momento che la pila funziona ugualmente anche con un elettrolita differente, in questa esperienza utilizzeremo un elettrolita meno pericoloso, come uno di quelli che abbiamo indicato fra i materiali, per esempio la soluzione di solfato di rame. Nonostante questa piccola modifica alla pila di Volta, il principio della produzione di energia elettrica per via chimica verrà ugualmente dimostrato. Se vorrete ugualmente utilizzare l'acido solforico, servitevi di una soluzione a bassa concentrazione ed un adulto dovrà essere presente per evitare ogni pericolo.
Montate ciascun dischetto di zinco sopra uno di rame in modo da avere sei coppie Cu-Zn. Ora, come mostrato in figura 11, mettete una coppia sopra l'altra, interponendo fra ciascuna coppia un dischetto di carta da filtri imbevuta della soluzione conduttrice. Fate attenzione a non fare gocciolare lateralmente la soluzione perchè essa metterebbe in cortocircuito gli elementi della pila. Notate che la sequenza dei materiali è questa: Cu, Zn, elettrolita, Cu, Zn, elettrolita, etc. Quando avrete finito di montare la pila di elementi, misurate la tensione fra la lamina di base (Cu) e quella di testa (Zn). Dovreste leggere 6,6 V, cioè 1,1 V per ciascuna coppia di elementi. La tensione prodotta varia anche in base all'elettrolita che userete e alla sua concentrazione. Come avete fatto con la pila al limone, alimentate un piccolo apparecchio a cristalli liquidi come un orologio o un termometro o anche una calcolatrice.
Con la sua invenzione, Alessandro Volta dette un forte impulso alle ricerche nel campo dell'elettricità. Circa un secolo dopo, queste scoperte portarono la luce elettrica, il telefono, la radio in milioni di case. Oggi, possiamo constatare l'importanza dell'energia elettrica in ogni momento della nostra vita.
MISURA DEI POTENZIALI DI RIDUZIONE
![]()
Un metodo alternativo di spiegare il funzionamento di una pila è quello che si basa
sulle reazioni di ossidoriduzione agli elettrodi. Nelle reazioni ossidoriduttive, si ha un
trasferimento di elettroni da una specie chimica (elemento) a un'altra. La tendenza di un
elemento ad acquistare o a perdere elettroni viene misurata come potenziale elettrico in
rapporto ad uno speciale elettrodo a idrogeno tenuto a 25 °C, al quale è attribuito per
convenzione potenziale zero: 2H+ + 2e- <---> H2.
Nel fare queste misure, viene utilizzata una pila che ha un elettrodo a idrogeno da una
parte e un elettrodo del materiale di cui si vuole conoscere il potenziale di riduzione
dall'altra. La tensione che viene prodotta da tale pila indica il potenziale di riduzione
in termini di una tensione positiva o negativa. Gli elementi chimici che hanno un
potenziale di riduzione positivo hanno una tendenza a ridursi, cioè ad acquistare
elettroni, mentre gli elementi che hanno un potenziale negativo, tendono a ossidarsi,
cioè a cedere elettroni.
A questo punto, la tensione prodotta da una pila può essere calcolata facendo la differenza dei potenziali di riduzione dei due semielementi E= E1 - E2.
| reazione | potenziale di riduzione (V) | |
|---|---|---|
| E1 | Cu++ + 2e- = Cu | + 0,342 |
| E2 | Zn++ + 2e- = Zn | - 0,762 |
Nel nostro caso la tensione che la pila fornisce sarà pari a:
E = +0,342 - (-0,762)
E = +1,104 V.
Si possono realizzare pile con tanti materiali diversi. Potete calcolare la tensione che otterrete attraverso le tabelle dei potenziali di riduzione forniti dai testi di chimica.
Veniamo ora alla parte sperimentale.
|
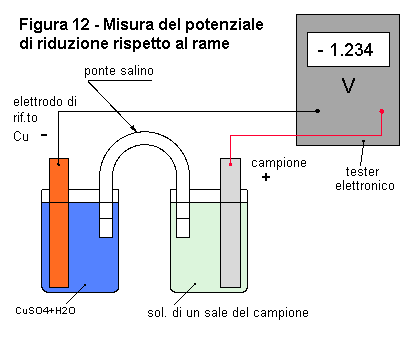
Materiali: - una lamina di rame |
Con i componenti descritti, realizzate un dispositivo come quello della figura 12, molto simile alla cella di Daniell a ponte salino. Mettete una soluzione 1 M di solfato di rame nel vaso dove c'è l'elettrodo di rame e una soluzione 1 M di un sale dell'elemento del campione nel vaso dove c'è il campione. Collegate il polo negativo del tester al rame e quello positivo al campione e misurate la tensione prodotta.
Perchè il dispositivo dia risultati validi, l'elettrodo di rame deve essere pulito e disossidato. Anche la superficie del campione deve essere pulita e disossidata. A tale scopo, potete servirvi di carta abrasiva. Alcuni metalli si ossidano molto facilmente. Questo è per esempio il caso dell'alluminio, titanio, magnesio. Disossidateli con la carta abrasiva subito prima della prova, poi, durante la prova, aspettate che la reazione rimuova quel sottile velo di ossido che si è formato dopo la smerigliatura. Vedrete la lancetta salire lentamente fino a raggiungere un massimo. Rilevate questo valore, che è il potenziale di riduzione del materiale in prova rispetto al rame. Se invece la tensione tende a calare, rilevate il valore più alto.
Le tensioni che misurate sono relative al rame. Per ottenere i valori relativi all'idrogeno, che sono quelli normalmente utilizzati, dovete sommare alle tensioni rilevate 0,34 V che è il potenziale del rame (Cu/Cu++) nei confronti dell'idrogeno. Per esempio, se con questo dispositivo misurerete il potenziale dello zinco, leggerete -1,1 V. Sommando 0,34 V, otterrete: -1,1 + (+0,34) = -0,76 V che è appunto il potenziale di riduzione dello zinco, cioè del semielemento Zn/Zn++ rispetto all'idrogeno.
Confrontate i valori ottenuti con le tavole dei potenziali di riduzione che potete trovare in un testo di chimica. Non aspettatevi di ottenere misure precise da questo dispositivo. In ogni caso, esso vi consentirà di effettuare numerose osservazioni.
Con questo metodo, provate metalli differenti, ma anche leghe metalliche e, se potete, anche plastiche, gomme e ceramiche conduttrici. Ci sono ricercatori che stanno tentando di mettere a punto pile con elettrodi in materiale plastico. Queste pile avrebbero il vantaggio della leggerezza. La speranza è quella di ottenere batterie leggere da utilizzare per le automobili elettriche.
|
Materiali: - due lamine di rame |
Le reazioni di ossidoriduzione avvengono con scambio di elettroni da una specie chimica all'altra e si raggiunge un livello energetico più basso. Nelle celle elettrolitiche, si fornisce energia elettrica per fare avvenire il processo chimico inverso a quello che avverrebbe spontaneamente. Ora, utilizzeremo questo principio per depositare metalli su di un elettrodo.
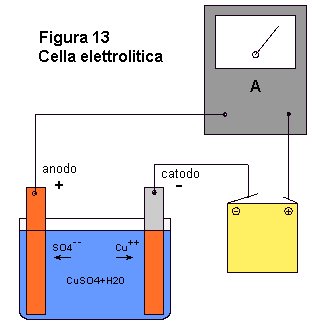
1° ESPERIMENTO: Soluzione di CuSO4 ed elettrodi di rame.
Realizzate una cella elettrolitica come indicato nella figura 13. A tale scopo, impiegate
una soluzione di solfato di rame come elettrolita (30 g di CuSO4 ogni 100 cc di
acqua) e lamine di rame come elettrodi. Con questa cella, poichè gli ioni solfato restano
nel sistema, mano a mano che ioni di rame si depositano sul catodo, altri atomi di rame
lasciano l'anodo e vanno in soluzione. Così facendo, potrete trasferire praticamente
tutto il rame dell'anodo al catodo, mentre le eventuali impurezze presenti nell'anodo si
depositeranno sul fondo. Quello che si ottiene è un deposito di rame molto puro. Questo
procedimento è usato anche in campo industriale proprio per purificare i metalli, che
raggiungono la cosiddetta purezza elettrolitica. Verificate con la bilancia analitica la
variazione di peso degli elettrodi prima e dopo aver fatto passare la corrente. Variando
la tensione, potete ottenere correnti diverse. Fate un grafico della variazione di peso
del catodo in funzione della corrente per tempi costanti.
2° ESPERIMENTO: Soluzione di CuSO4 e lamine di zinco e di ferro.
|
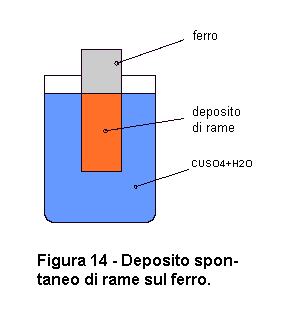
Alcuni di voi si saranno chiesti perchè non utilizziamo un catodo di zinco per rendere visibile il deposito di rame. Infatti, in virtù del suo colore arancione, il rame si distinguerebbe molto bene sullo zinco che è grigio. In questo modo, si potrebbe evitare di utilizzare la bilancia per verificare l'avvenuto deposito del rame. Il problema è che, immergendo l'elettrodo di zinco nella soluzione contenente ioni di rame, la lamina di zinco si ricoprirebbe di rame prima ancora di collegare la pila. Infatti, gli ioni di rame si depositano spontaneamente sullo zinco. Come ormai sappiamo, questo avviene perchè gli atomi di rame sono più avidi di elettroni di quanto non siano quelli di zinco. Quando immergiamo una lamina di zinco in una soluzione contenente ioni di rame, alcuni atomi di zinco vanno in soluzione come Zn++ e lo stesso numero di ioni Cu++ si deposita sullo zinco, dove preleva gli elettroni ceduti dagli atomi di zinco andati in soluzione e si neutralizza. La lamina di zinco si ricopre in modo visibile di uno strato di rame. Normalmente non avrete un deposito metallico compatto, ma una cristallizzazione dendritica di consistenza polverulenta e di colore nerastro. Se invece utilizzerete una lamina di ferro al posto dello zinco otterrete un sottile deposito compatto di rame (fig. 14). Fate alcune prove per verificare questo fenomeno. |
3° ESPERIMENTO: Soluzione di CuSO4 e catodo di acciaio inossidabile.
L'acciaio inossidabile si presta bene a mostrare in modo qualitativo la deposizione
elettrolitica di rame sul catodo. Infatti, l'acciaio inossidabile ha un colore grigio
chiaro, tuttavia, se lo immergete in una soluzione di solfato di rame, non si ricoprirà
spontaneamente di rame, ma dovrete applicare una tensione agli elettrodi. Questo avviene
perchè l'acciaio inossidabile ha un potenziale di riduzione maggiore di quello del rame.
Facendo riferimento alla figura 13, impiegate la lamina di acciaio inossidabile come
catodo e applicate la tensione di una pila. Dopo che avrete fatto questo, quella parte di
del catodo immersa nell'elettrolita si ricoprirà di un sottile strato di rame. Il colore
differente dei due metalli mostrerà l'avvenuta deposizione di rame, senza dovere
effettuare accurate misure di peso.
Nel corso di questi esperimenti, potete verificare la legge di Faraday, secondo cui la quantità di elettroni forniti è pari alla quantità di cariche ioniche spostate. Quindi, il peso delle sostanze trasformate è direttamente proporzionale alla quantità di corrente fornita e al peso molecolare degli ioni, ed è inversamente proporzionale al numero di cariche che la sostanza possiede allo stato ionico. Per esempio, la stessa quantità di corrente che deposita un certo numero di ioni con carica 1, depositerà la metà di ioni con carica 2.
I depositi elettrolitici sono molto utilizzati nel campo industriale nei trattamenti di superficie dei metalli. Questi trattamenti hanno per scopo di ottenere strati protettivi contro l'ossidazione, oppure hanno scopi decorativi. In gioielleria, si usa depositare sottili strati d'oro su metalli di scarso valore per ottenere prodotti meno costosi, ma ugualmente belli da vedere. Anche in elettronica si impiegano depositi d'oro. In questo caso, l'oro viene utilizzato per le sue proprietà di non ossidarsi e di mantenere la capacità di stabilire un ottimo contatto elettrico anche dopo molto tempo e molte interruzioni. Con le tecniche di galvanoplastica, si effettuano anche ossidazioni superficiali dei metalli, con scopi decorativi o protettivi. Questo è per esempio il caso dell'alluminio che, con l'ossidazione anodica, può assumere colori differenti, fra i quali anche il nero.
|
Nel corso di questi esperimenti, avete preso confidenza con fenomeni semplici come la conduttività delle soluzioni per mezzo degli ioni, avete fatto amicizia con le reazioni ossidoriduttive e avete visto che fornendo una tensione esse possono essere invertite. Avete imparato a misurare il potenziale di riduzione dei materiali e a prevedere la tensione di una pila partendo dal materiale degli elettrodi. Avete anche imparato a realizzare pile. Ora sapete benissimo che la pila al limone funzionerà altrettanto bene utilizzando un pomodoro, oppure una patata, una mela, un ananas, insomma qualsiasi frutto od ortaggio. Fino ad ora, avevamo sempre guardato le pile come degli oggetti misteriosi. Ben poche persone sanno come funzionino questi dispositivi, e noi siamo fra queste! Ora potete improvvisare pile utilizzando materiali diversi, cosa che non mancherà di stupire quelli che vi osserveranno. Ma, quello che è più importante, è che ora lo studio di questa materia sarà vi sarà più facile. |
|
---oOo---
Ringraziamo la D.ssa Patrizia Buttol per la revisione del testo e per i preziosi suggerimenti.